![]()
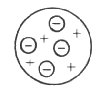 Em 1903, o cientista inglês Joseph
J. Thomson, baseado em experiências realizadas com gases e que mostraram que a matéria
era formada por cargas elétricas positivas e negativas, modificou o modelo atômico de
Dalton. Segundo Thomson, o átomo seria uma esfera maciça e positiva com as cargas
negativas distribuídas, ao acaso, na esfera. A quantidade de cargas positivas e negativas
seriam iguais e dessa forma o átomo seria eletricamente neutro. O modelo proposto por
Thomson ficou conhecido como "pudim com passas".
MODELO ATÔMICO DE
RUTHERFORD
Em 1911, o cientista
neozelandês Ernest Rutherford, utilizando os fenômenos radiativos no estudo da estrutura
atômica, descobriu que o átomo não seria uma esfera maciça, mas sim formada por uma
região central, chamada núcleo atômico, e uma região externa ao núcleo, chamada
eletrosfera. No núcleo atômico estariam as partículas positivas, os prótons, e na
eletrosfera as partículas negativas, os elétrons.
Em 1903, o cientista inglês Joseph
J. Thomson, baseado em experiências realizadas com gases e que mostraram que a matéria
era formada por cargas elétricas positivas e negativas, modificou o modelo atômico de
Dalton. Segundo Thomson, o átomo seria uma esfera maciça e positiva com as cargas
negativas distribuídas, ao acaso, na esfera. A quantidade de cargas positivas e negativas
seriam iguais e dessa forma o átomo seria eletricamente neutro. O modelo proposto por
Thomson ficou conhecido como "pudim com passas".
MODELO ATÔMICO DE
RUTHERFORD
Em 1911, o cientista
neozelandês Ernest Rutherford, utilizando os fenômenos radiativos no estudo da estrutura
atômica, descobriu que o átomo não seria uma esfera maciça, mas sim formada por uma
região central, chamada núcleo atômico, e uma região externa ao núcleo, chamada
eletrosfera. No núcleo atômico estariam as partículas positivas, os prótons, e na
eletrosfera as partículas negativas, os elétrons.
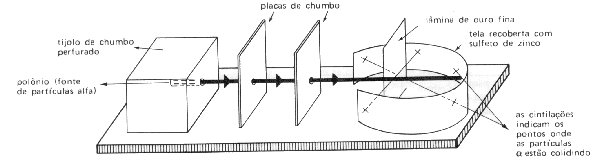 Para chegar a essas
conclusões Rutherford e seus colaboradores bombardearam lâminas de ouro com partículas
a (2 prótons e 2 nêutrons) utilizando a aparelhagem esquematizada acima.
Rutherford observou
que a grande maioria das partículas atravessava normalmente a lâmina de ouro que
apresentava aproximadamente 10-5 cm de espessura. Outras partículas sofriam
pequenos desvios e outras, em número muito pequeno, batiam na lâmina e voltavam. O
caminho seguido pelas partículas a podia ser detectado devido ?s cintilações que elas
provocavam no anteparo de sulfeto de zinco.
Comparando o número
de partículas a lançadas com o número de partículas a que sofriam desvios, Rutherford
calculou que o raio do átomo deveria ser 10.000 a 100.000 vezes maior do que o raio do
núcleo, ou seja, o átomo seria formado por espaços vazios.
Para chegar a essas
conclusões Rutherford e seus colaboradores bombardearam lâminas de ouro com partículas
a (2 prótons e 2 nêutrons) utilizando a aparelhagem esquematizada acima.
Rutherford observou
que a grande maioria das partículas atravessava normalmente a lâmina de ouro que
apresentava aproximadamente 10-5 cm de espessura. Outras partículas sofriam
pequenos desvios e outras, em número muito pequeno, batiam na lâmina e voltavam. O
caminho seguido pelas partículas a podia ser detectado devido ?s cintilações que elas
provocavam no anteparo de sulfeto de zinco.
Comparando o número
de partículas a lançadas com o número de partículas a que sofriam desvios, Rutherford
calculou que o raio do átomo deveria ser 10.000 a 100.000 vezes maior do que o raio do
núcleo, ou seja, o átomo seria formado por espaços vazios.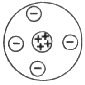 Por esses espaços vazios a grande
maioria das partículas a atravessava a lâmina de ouro.
Os desvios sofridos pelas
partículas a eram devidos às repulsões elétricas entre o núcleo (positivo) e as
partículas a, também positivas, que a ele se dirigiam. O modelo de Rutherford (figura ao
lado) ficou conhecido como "modelo planetário".
Partículas
elementares
A experiência de
Rutherford mostrou que no núcleo atômico além do próton deveria existir uma outra
partícula. Esta foi descoberta em 1932 pelo cientista inglês James Chadwick e recebeu o
nome de nêutron.
Prótons, elétrons
e nêutrons são as principais partículas presentes num átomo. Elas são chamadas
partículas elementares ou subatômicas e suas principais características são:
Por esses espaços vazios a grande
maioria das partículas a atravessava a lâmina de ouro.
Os desvios sofridos pelas
partículas a eram devidos às repulsões elétricas entre o núcleo (positivo) e as
partículas a, também positivas, que a ele se dirigiam. O modelo de Rutherford (figura ao
lado) ficou conhecido como "modelo planetário".
Partículas
elementares
A experiência de
Rutherford mostrou que no núcleo atômico além do próton deveria existir uma outra
partícula. Esta foi descoberta em 1932 pelo cientista inglês James Chadwick e recebeu o
nome de nêutron.
Prótons, elétrons
e nêutrons são as principais partículas presentes num átomo. Elas são chamadas
partículas elementares ou subatômicas e suas principais características são:
| Partícula | Massa (grama) | Massa relativa | Carga elétrica (Coulomb) | Carga relativa |
| Próton (p+) | 1,7.10-24 | 1 | +1,6.10-19 | +1 |
| Nêutron (n0) | 1,7.10-24 | 1 | 0 | 0 |
| Elétron (e-) | 9,1.10-28 | 1/1840 | -1,6.10-19 | -1 |
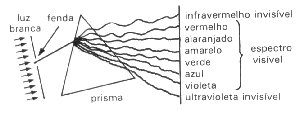 No entanto, se a luz
que atravessar o prisma for de uma substância como hidrogênio, sódio, neônio etc.
será obtido um espectro descontínuo. Este é caracterizado por apresentar linhas
coloridas separadas. Em outras palavras, somente alguns tipos de radiações luminosas
são emitidas, isto é, somente radiações com valores determinados de energia são
emitidas.
Baseado nessas
observações experimentais, Bohr elaborou um novo modelo atômico cujos postulados são:
No entanto, se a luz
que atravessar o prisma for de uma substância como hidrogênio, sódio, neônio etc.
será obtido um espectro descontínuo. Este é caracterizado por apresentar linhas
coloridas separadas. Em outras palavras, somente alguns tipos de radiações luminosas
são emitidas, isto é, somente radiações com valores determinados de energia são
emitidas.
Baseado nessas
observações experimentais, Bohr elaborou um novo modelo atômico cujos postulados são:
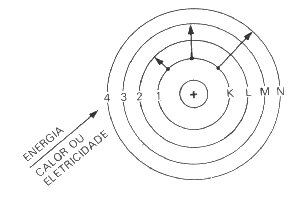
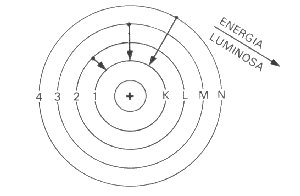 Esses postulados
permitem explicar a existência dos espectros de emissão descontínuos: como o elétron
só pode ocupar determinadas órbitas, as transições eletrônicas (ida e volta do
elétron) ocorrem em número restrito, o que produz somente alguns tipos de radiação
eletromagnética e não todas como no espectro contínuo.
Modelo atômico de
Bohr foi elaborado para o átomo de hidrogênio, mas aplica-se com boa aproximação a
todos os outros átomos.
Esses postulados
permitem explicar a existência dos espectros de emissão descontínuos: como o elétron
só pode ocupar determinadas órbitas, as transições eletrônicas (ida e volta do
elétron) ocorrem em número restrito, o que produz somente alguns tipos de radiação
eletromagnética e não todas como no espectro contínuo.
Modelo atômico de
Bohr foi elaborado para o átomo de hidrogênio, mas aplica-se com boa aproximação a
todos os outros átomos.
CONCEITOS
Próton: partícula nuclear com carga positiva igual, em grandeza, à do elétron. Junto com o nêutron, está presente em todos os núcleos atômicos (exceto o do hidrogênio, que não tem nêutron). A massa de um próton é de 1,6726 x 10-27 kg, ou seja, 1.836 vezes a do elétron. O número atômico de um elemento indica o número de prótons em seu núcleo e determina de que elemento se trata.O antipróton é sua antipartícula. É estável no vácuo e não se desintegra espontaneamente. Nêutron: uma das partículas fundamentais que compõem a matéria. Sua massa é de 1,675 x 10-27 kg, aproximadamente 0,125% maior que a do próton. Não tem carga elétrica. É uma partícula constituinte de todos os núcleos, exceto o do hidrogênio comum. Os nêutrons livres, que formam parte de um núcleo, são produzidos em reações nucleares. Quando é expulso do núcleo, o nêutron é instável, e se desintegra para dar lugar a um próton, um elétron e um neutrino. O uso de feixes de nêutrons é uma ferramenta importante em campos tão diversos quando a paleontologia, a arqueologia e a história da arte.Elétron: tipo de partícula elementar que, junto com os prótons e os nêutrons, forma os átomos e as moléculas. Intervém em uma grande variedade de fenômenos. Os elétrons têm uma massa em repouso de 9,109 x 10
-31 kg e uma carga elétrica negativa de 1,602 x 10-19 coulombs. Sua partícula de antimatéria correspondente é o pósitron.TEXTO 1 - Prêmio Nobel de Química 1999 - Outubro 99
No dia 12 de outubro de 1999, a Real Academia Sueca de Ciências anunciou a concessão do Prêmio Nobel de Química ao pesquisador, de dupla nacionalidade (egípcia e norte-americana), Ahmed H. Zewail, "por ter demonstrado que é possível observar, graças a uma técnica a laser ultra-rápida, o movimento dos átomos de uma molécula durante as reações químicas". Zewail é o inventor de uma técnica que pode ser descrita como uma câmara fotográfica capaz de captar com precisão a forma como se comportam os átomos durante o exato momento de uma reação química. Ahmed H.Zewail nasceu em 1946, no Egito. Fez seus primeiros estudos de Química na Universidade de Alexandria. Depois foi para os Estados Unidos, onde se doutorou em 1974, na Universidade da Pensilvânia. Trabalhou na Universidade de Berkeley e, em 1976, tornou-se pesquisador do Instituto de Tecnologia da Califórnia, onde desde 1990 ocupa a cátedra Linus Pauling de Química.Link:
Centenário da Radiotividade: Site comemorativo dos 100 anos da descoberta da radiotividade. Disponível em inglês, espanhol e francês.
![]()