TERMOQUÍMICA
A energia liberada nas reações químicas está presente em várias atividades da nossa vida diária. Por exemplo, á o calor liberado na queima do gás butano que cozinha os nossos alimentos, é o calor liberado na combustão do álcool ou da gasolina que movimenta nossos veículos e á através das reações químicas dos alimentos no nosso organismo que obtemos a energia necessária para manutenção da vida.
A maioria das reações químicas ocorre produzindo variações de energia, que freqüentemente se manifestam na forma de variações de calor. A termoquímica ocupa-se do estudo quantitativo das variações térmicas que acompanham as reações químicas. Essas reações são de dois tipos:
Reações exotérmicas: as que liberam calor para o meio ambiente.
Exemplos
combustão (queima) do gás butano, C4H10
C4H10(g) + 13/2 O2(g) => 4 CO2(g) + 5H20(g) + calor
combustão do etanol, C2H60:
C2H60(l) + 3O2(g) => 2 CO2(g) + 3 H2O(g) + calor
Na equação química, o calor é representado junto aos produtos para significar que foi produzido, isto á, liberado para o ambiente durante a reação.
Reações endotérmicas: as que para ocorrerem retiram calor do meio ambiente.
Exemplos
decomposição da água em seus elementos:
H20(l) + calor => H2(g) + 1/2 O2(g)
fotossíntese:
6 CO2(g) + 6 H20(l) + calor => C6H12O6(aq) + 6 O2(g)
Na equação química, a energia absorvida á representada junto aos reagentes, significando que foi fornecida pelo ambiente aos reagentes.
MEDIDA DO CALOR DE REAÇÃO
O calor liberado ou absorvido por um sistema que sofre uma reação química á determinado em aparelhos chamados calorímetros. Estes variam em detalhes e são adaptados para cada tipo de reação que se quer medir o calor. Basicamente, no entanto, um calorímetro é constituído de um recipiente com paredes adiabáticas, contendo uma massa conhecida de parede água, onde se introduz um sistema em reação. O recipiente é provido de um agitador e de um termômetro que mede a variação de temperatura ocorrida durante a reação.
A determinação do calor liberado ou absorvido numa reação química á efetuada através da expressão:
![]()
onde:
Q é a quantidade de calor liberada ou absorvida pela reação. Esta grandeza pode ser expressa em calorias (cal) ou em Joules (J). O Sistema Internacional de Medidas (SI) recomenda a utilização do Joule, no entanto, a caloria ainda é muito utilizada. Uma caloria (1 cal) é a quantidade de calor necessária para fazer com que 1,0 g de água tenha sua temperatura aumentada de 1,0ºC. Cada caloria corresponde a 4,18 J;
m é a massa, em gramas, de água presente no calorímetro;
c é o calor especifico do liquido presente no calorímetro. Para a água seu valor é 1 cal/g . ºC;
![]() é a variação de temperatura sofrida pela massa de água
devido a ocorrência da reação. É medida em graus Celsius.
é a variação de temperatura sofrida pela massa de água
devido a ocorrência da reação. É medida em graus Celsius.
A rigor, deve-se considerar a capacidade térmica do calorímetro que inclui, além da capacidade térmica da água, as capacidades térmicas dos materiais presentes no calorímetro (agitador, câmara de reação, fios, termômetro etc.).
O calor de reação pode ser medido a volume constante, num calorímetro hermeticamente fechado, ou à pressão constante, num calorímetro aberto. Experimentalmente, verifica-se que existe uma pequena diferença entre esses dois tipos de medidas calorimétricas. Essa diferença ocorre porque, quando uma reação ocorre à pressão constante, pode haver variação de volume e, portanto, envolvimento de energia na expansão ou contração do sistema.
A variação de energia determinada a volume constante é chamada de variação de energia interna, representada por ?E, e a variação de energia determinada à pressão constante é chamada de variação de entalpia, representada por ?H.
Como a maioria das reações químicas são realizadas em recipientes abertos, à pressão atmosférica local, estudaremos mais detalhadamente a variação de entalpia das reações.
ENTALPIA E VARIAÇÃO DE ENTALPIA
O calor, como sabemos, é uma forma de energia e, segundo a Lei da Conservação da Energia, ela não pode ser criada e nem destruída, pode apenas ser transformada de uma forma para outra. Em vista disso, somos levados a concluir que a energia:
liberada por uma reação química não foi criada, ela já existia antes, armazenada nos reagentes, sob uma outra forma;
absorvida por uma reação química não se perdeu, ela permanece no sistema, armazenada nos produtos, sob uma outra forma.
Cada substância, portanto, armazena um certo conteúdo de calor, que será alterado quando a substância sofrer uma transformação. A liberação de calor pela reação exotérmica significa que o conteúdo total de calor dos produtos á menor que o dos reagentes. Inversamente, a absorção de calor por uma reação endotérmica significa que o conteúdo total de calor armazenado nos produtos é maior que o dos reagentes.
A energia armazenada nas substâncias (reagentes ou produtos) dá-se o nome de conteúdo de calor ou entalpia. Esta é usualmente representada pela letra H.
Numa reação, a diferença entre as entalpias dos produtos e dos
reagentes corresponde à variação de entalpia, ![]() .
.
![]()
onde:
Hp = entalpia dos produtos;
Hr = entalpia dos reagentes.
Numa reação exotérmica temos que Hp < Hr e,
portanto, ![]() < O (negativo).
< O (negativo).
Numa reação endotérmica temos que Hp > Hr
e, portanto, ![]() > O (positivo).
> O (positivo).
Equações termoquímicas e gráficos de entalpia
As reações, como sabemos, são representadas através de equações químicas. No caso da representação de uma reação que ocorre com variação de calor, é importante representar, além da quantidade de calor envolvida, as condições experimentais em que a determinação dessa quantidade de calor foi efetuada. Isso porque o valor do calor de reação é afetado por fatores como a temperatura e a pressão em que se processa a reação, o estado físico e as variedades alotrópicas das substâncias participantes dessa reação. A equação que traz todas essas informações chama-se equação termoquímica.
Exemplos de equações termoquímicas:
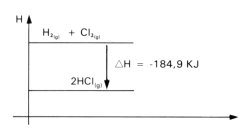
H2(g) + Cl2(g) => 2 HCl(g) + 184,9 kJ (25ºC, 1 atm)
Segundo a equação, 1 mol de hidrogênio gasoso reage com 1 mol de cloro gasoso formando 2 mols de cloreto de hidrogénio gasoso, liberando 184,9 kJ de calor. Tal reação foi realizada à temperatura de 25ºC e à pressão de 1 atm.
Podemos também escrever essa equação termoquímica utilizando a notação ?H. Neste caso temos:
H2(g) + Cl2(g) => 2 HCl(g), ![]() = -184,9 kJ
(25ºC, 1 atm)
= -184,9 kJ
(25ºC, 1 atm)
O valor numérico de ![]() é precedido do sinal negativo pois a reação é
exotérmica.
é precedido do sinal negativo pois a reação é
exotérmica.
Graficamente, a variação de entalpia que acompanha a reação é representada por:
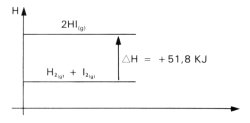
H2(g) + I2(g) + 51,8 kJ => 2 HI (g) (25ºC, 1 atm)
Segundo a equação, quando, a 25ºC e 1 atm, 1 mol de hidrogênio gasoso reage com 1 mol de iodo gasoso, formando 2 mols de iodeto de hidrogênio gasoso, são absorvidos 51,8 kJ de calor.
A equação também pode ser escrita utilizando a notação AH:
H2(g) + I2(g) => 2 HI (g) AH = + 51,8 kJ (25ºC, 1 atm)
O valor numérico de AH é positivo, pois a reação é endotérmica.
Graficamente a variação de entalpia dessa reação pode ser representada por:
DETERMINAÇAO INDIRETA DO CALOR DE REAÇAO
Vimos anteriormente que a variação de entalpia de uma reação á determinada experimentalmente no calorímetro. Existem, no entanto, maneiras indiretas de determinação da variação de entalpia de uma reação. A seguir, discutiremos as mais importantes.
Determinação através da definição de ![]()
Já vimos que a variação de entalpia AH de uma reação á a diferença entre as entalpias dos produtos e reagentes de uma reação.
![]() = Hp - Hr
= Hp - Hr
Portanto, se conhecêssemos as entalpias absolutas das substâncias, poderíamos calcular, facilmente, a variação de entalpia associada a qualquer reação. Como isto á impossível, pois apenas a diferença das entalpias dos produtos e reagentes pode ser medida, os químicos resolveram atribuir, arbitrariamente, a um grupo de substâncias um determinado valor de entalpia e, a partir disso, construir uma escala relativa de entalpias das demais substâncias.
Assim, atribuiu-se às variedades alotrópicas mais estáveis das substâncias simples, a 25ºC e 1 atm, entalpias iguais a zero. Essas condições experimentais são chamadas de condições padrão ou estado padrão, e a entalpia, determinada nessas condições, á a entalpia padrão. A entalpia padrão á representada por H0.
Por exemplo, têm entalpias padrão zero as substâncias: 02 gasoso, H2 gasoso, I2 sólido, C grafite, S8 rômbico etc., e têm entalpias padrão diferentes de zero as substâncias: 02 liquido, 03 gasoso, H2 liquido, I2 gasoso, C diamante, S8 monoclínico etc.
A entalpia padrão de uma substância qualquer pode ser calculada tomando-se como referência a variação de entalpia da reação de formação, também chamada de entalpia de formação, dessa substância a partir de seus elementos, no estado padrão.
Calor de formação ou entalpia de formação é o nome dado à variação de entalpia associada à formação de um mol de uma substância a partir de seus elementos constituintes, na forma de substâncias simples mais estável e no estado padrão.
A entalpia de formação é representada por ![]() 0f.
0f.
Exemplo
![]()
Acompanhe a seguir a determinação da entalpia padrão do dióxido de carbono gasoso:
Reação de formação do C02(g):

A tabela a seguir traz as entalpias padrão de algumas substâncias.
Entalpia padrão ( |
|
H20 (l) HCl (g) HBr (g) Hl (g) CO (g) CO2 (g) NH3 (g) SO2 (g) CH4 (g) C2H4 (g) C2H6 (g) C2H2 (g) C6H6 (l) |
- 68,3 - 22,0 - 8,6 + 6,2 - 26,4 - 94,1 - 11,0 - 70,9 - 17,9 + 11,0 - 20,5 + 53,5 + 12,3 |
Conhecendo-se as entalpias padrão das substâncias, a variação de entalpia de uma reação pode ser determinada com facilidade.
Lei de Hess
Em 1849, o químico Germain Henri Hess, efetuando inúmeras medidas dos calores de reação, verificou que:
O calor liberado ou absorvido numa reação química depende apenas dos estados intermediários pelos quais a reação passa.
Esta é a lei da atividade dos calores de reação ou lei de Hess.
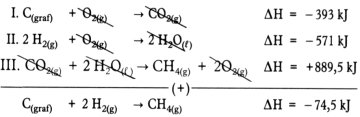
De acordo com essa lei é possível calcular a variação de entalpia de uma reação através da soma algébrica de equações químicas que possuam conhecidos. Por exemplo, a partir das equações:
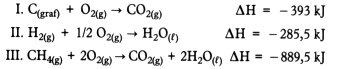
é possível determinar a variação de entalpia da reação de formação do metano, CH4, reação essa que não permite medidas calorimétricas precisas de seu calor de reação por ser lenta e apresentar reações secundárias.
A soma algébrica das reações dadas deve, portanto, resultar na reação de formação do metano, cujo queremos determinar:
![]()
No entanto, para obtermos essa equação devemos efetuar as seguintes operações:
multiplicar a reação II por 2, para que o número de mols de H2(g) seja igual a 2, consequentemente o também será multiplicado por 2;
inverter a reação III, para que CH4(g) passe para o segundo membro da equação. Em vista disso, o também terá seu sinal invertido, isto é, se a reação é exotérmica, invertendo-se o seu sentido, passará a ser endotérmica e vice-versa;
somar algebricamente as equações e os ![]() .
.
Assim temos:
Energia de ligação
É a energia fornecida para romper 1 mol de ligações entre dois átomos e um sistema gasoso, a 25ºC e 1 atm.
A energia de ligação pode ser determinada experimentalmente. Na tabela tabela abaixo estão relacionadas as energias de algumas ligações.
| Ligação | Energia de ligação kcal/mol de ligações |
| H - H | 104,2 |
| Cl - Cl | 57,8 |
| H - Cl | 103,0 |
| O = O | 118,3 |
| Br - Br | 46,1 |
| H - Br | 87,5 |
| C - C | 83,1 |
| C - H | 99,5 |
| C - Cl | 78,5 |
Observe que os valores tabelados são todos positivos, isto porque o rompimento de ligações é um processo que consome energia, ou seja, é um processo endodérmico. A formação de ligações, ao contrário, é um processo que libera energia, processo exotérmico.
Para se determinar o ![]() de uma reação a partir dos valores devemos
considerar:
de uma reação a partir dos valores devemos
considerar:
que todas as ligações dos reagentes são rompidas e determinar a quantidade de energia consumida nesse processo;
que as ligações existentes nos produtos foram todas formadas a partir de átomos isolados e determinar a quantidade de energia liberada nesse processo.
O ![]() será correspondente à soma algébrica das energias
envolvidas nos dois processos, o de ruptura e o de formação de ligações. É importante
salientar que este método fornece valores aproximados de
será correspondente à soma algébrica das energias
envolvidas nos dois processos, o de ruptura e o de formação de ligações. É importante
salientar que este método fornece valores aproximados de ![]() . Ele é muito útil na previsão da
ordem de grandeza da variação de entalpia de uma reação.
. Ele é muito útil na previsão da
ordem de grandeza da variação de entalpia de uma reação.
TIPOS DE CALORES E ESPONTANEIDADE DAS REAÇÕES
A variação da entalpia recebe uma denominação particular da natureza da reação:
Calor de combustão ou entalpia de combustão: É ![]() associado à reação de combustão, no estado padrão, de um mol de uma substância.
associado à reação de combustão, no estado padrão, de um mol de uma substância.
![]()
Calor de dissolução ou entalpia de dissolução: É
o ![]() associado a 1 mol de uma substância em água suficiente para preparar um solução
diluída.
associado a 1 mol de uma substância em água suficiente para preparar um solução
diluída.
![]()
Calor de neutralização ou entalpia de neutralização:
É o ![]() da reação de neutralização de 1 equivalente-grama de um ácido por 1 equivalente de
uma base, ambos na forma de soluções aquosas dilúidas,
da reação de neutralização de 1 equivalente-grama de um ácido por 1 equivalente de
uma base, ambos na forma de soluções aquosas dilúidas,
![]()
Espontaneidade das reações
Muito dos processos que ocorrem à sua volta são espontâneos, isto é, uma vez iniciados prosseguem sem a necessidade de ajuda externa. A dissolução do sal em água, a queima de carvão são exemplos de processos espontâneos.
Os processos espontâneos são aqueles que apenas são possíveis através do fornecimento contínuo de energia do meio ambiente. O cozimento de alimentos, a obtenção de metais, são exemplos de processos não espontâneos.
A constatação de que a maioria dos processos espontâneos ocorrem com liberação de energia, levou à idéia de que apenas processos exotérmicos, que ocorriam com diminuição de energia do sistema, eram espontâneos. De fato, isto é verdade para muitas reações; existem, no entanto, processos espontâneos que absorvem calor. Portanto, além do fator energia, existe um outro que influencia a espontaneidade de um processo. Este fator chama-se entropia, e é representado pela letra S.
A entropia está associada à ordem ou à desordem de um sistema. Quanto mais desorganizado o sistema, maior será sua entropia. Exemplos de processos que ocorrem com aumento de entropia:
a dissolução de qualquer substância em um liquido tambem produz um sistema em que a desorganização á maior.
Da mesma forma que para a entalpia, para a determinação da entropia das substâncias foi necessário estabelecer, arbitrariamente, a entropia de algumas substâncias e, a partir disso, construir uma escala relativa de entropias. Estabeleceu-se que uma substância, na forma de um cristal perfeito, a zero Kelvin, tem entropia zero.
A tabela a seguir relaciona as entropias padrão
(sº) de algumas substâncias.| Entropia padrão (cal/mol . K) a 25ºC | |
| Ca (g) | 9,95 |
| Ag (g) | 10,20 |
| CaO (g) | 9,5 |
| Br2 (l) | 36,4 |
| Hg (l) | 18,17 |
| He (gás) | 30,13 |
| N2 (gás) | 45,7 |
| Metano, CH4 (gás) | 44,5 |
A espontaneidade de uni processo é determinada pelos fatores entalpia e entropia. São espontâneos os processos que ocorrem com diminuição de entalpia e aumento de entro. pia. Não são espontâneos os processos que ocorrem com aumento de entaipia e diminuição de entropia. Quando um processo ocorre com aumento ou diminuição simultânea de eutalpia e entropia, para se prever a espontaneidade ou não da reação é necessário lançar mão de uma grandeza que relaciona a entropia e a entalpia. Esta grandeza é a energia livre de Gibbs (G) e é dada pela equação:
![]()
![]() é a variação de energia
livre do sistema, dada em kcal/mol;
é a variação de energia
livre do sistema, dada em kcal/mol;
![]() é a variação de entalpia,
dada em kcallmol;
é a variação de entalpia,
dada em kcallmol;
![]() é a variação dc entropia, dada em cal/K . mol.
é a variação dc entropia, dada em cal/K . mol.
![]()